Las nanopartículas para tratar o diagnosticar enfermedades
En 1959, el famoso físico estadounidense Richard Feynman dio una charla considerada el origen de la nanotecnología1. Entre otras cosas muy interesantes, contó que un amigo suyo le dijo “… aunque es una idea muy descabellada, sería interesante en cirugía poder tragarse al cirujano. El cirujano se introduce en las válvulas sanguíneas, entra en el corazón y «mira» a su alrededor. Averigua cuál es la válvula defectuosa, coge un pequeño cuchillo y la corta. Otras pequeñas máquinas podrían incorporarse permanentemente al cuerpo para ayudar a algún órgano que no funcione correctamente.”
Esta idea que parecía algo alocada está empezando a ser una realidad gracias a los nanomateriales. En las últimas décadas, ha aparecido una nueva rama de la ciencia conocida como “nanomedicina” o el uso de los nanomateriales para el diagnóstico y tratamiento de enfermedades.
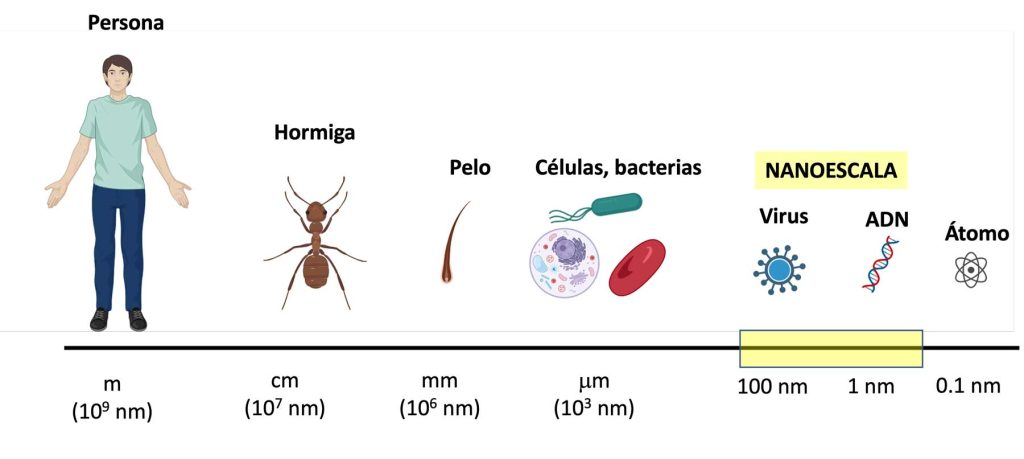
El prefijo “nano” proviene de la palabra griega “nano”, que significa “enano”; un nanómetro equivale a la mil millonésima parte de un metro. Por tanto, a modo general, los nanomateriales se definen como aquellos materiales con una o más dimensiones en el rango de tamaño de 1 nm – 100 nm. Los nanomateriales son invisibles al ojo humano, siendo muchísimo más pequeños que un grano de arena o un cabello y sólo pueden ser observados con microscopios muy potentes (Figura 1). Estos nanomateriales pueden estar formados por nanopartículas. Las nanopartículas tienen una o más dimensiones en la nanoescala.
Seguramente, conocerás las nanopartículas, aunque probablemente no las hayas visto nunca. La vacuna para el Covid19, las cremas solares o las vidrieras de colores de las catedrales son algunos ejemplos de objetos de la vida cotidiana que contienen nanopartículas.
Gracias a su pequeño tamaño, las nanopartículas tienen propiedades únicas, muy diferentes a las del material a escala macroscópica. Seguro que, si piensas en el oro, te viene a la cabeza el color dorado. Pero las nanopartículas de oro nunca serán doradas; de hecho, su color dependerá principalmente de su tamaño (Figura 2). Estas propiedades nuevas se deben principalmente a un aumento de la relación entre la superficie del material y su volumen.
Los científicos y las científicas pueden diseñar “a la carta” estas nanopartículas para que tengan un cierto tamaño, forma o propiedades, en función de la aplicación deseada2. Por ejemplo, pueden hacer que las nanopartículas incorporen una especie de “radar” o “sonda” para saber a qué células y tejidos se tienen que dirigir.
Las células tienen en la parte exterior de su membrana proteínas que actúan como receptores de la información. Las sondas de las nanopartículas buscan estos receptores y cuando los encuentran, se unen a ellos como si fueran llaves que encajan en las cerraduras. Esto hace que la célula reciba un mensaje o una señal que puede activar o cambiar algo dentro de la célula. Por ejemplo, la célula puede reparar algo que funcione mal en su interior o abrir su membrana para que un medicamento llegue al citoplasma.
Imagínate que nuestras nanopartículas, además de tener ese “radar”, pueden transportar diversas sustancias (por ejemplo, medicamentos para tratar el cáncer). Como saben llegar al tumor, llevarán el medicamento solamente al sitio dónde ese se necesita, sin “perderlo” por el camino o llevarlo a las células sanas. De esta manera, las nanopartículas permiten transportar medicamentos de manera más eficiente y selectiva y disminuyen los efectos secundarios asociados con la quimioterapia tradicional.
Las nanopartículas también pueden servir para el diagnóstico de enfermedades, como ocurre por ejemplo con las pruebas rápidas de antígenos para diagnosticar la gripe y la Covid19. En estos dispositivos se usan normalmente nanopartículas coloreadas, ya que permiten obtener el resultado de una forma muy fácil, simplemente observando la aparición de un color.
¿Cómo investigamos el viaje y transformación de las nanopartículas por el cuerpo? El ejemplo de las nanopartículas magnéticas
Para poder usar las nanopartículas en tratamientos, es importante saber qué ocurre con ellas una vez administradas al paciente. ¿Cuánto tiempo están dentro del cuerpo? Realmente, ¿llegan al sitio deseado? ¿Se transforman o se eliminan de alguna manera? Todo esto se llama biodistribución.
En nuestro caso, hemos estudiado la biodistribución de nanopartículas magnéticas en ratones. ¿Por qué lo hemos hecho en ratones y no en humanos directamente? Porque antes de probar el funcionamiento de cualquier medicamento o tratamiento (con o sin nanopartículas) en humanos, se hace en otros animales, siempre teniendo en cuenta su bienestar y cumpliendo las normas específicas de manejo de animales de laboratorio.
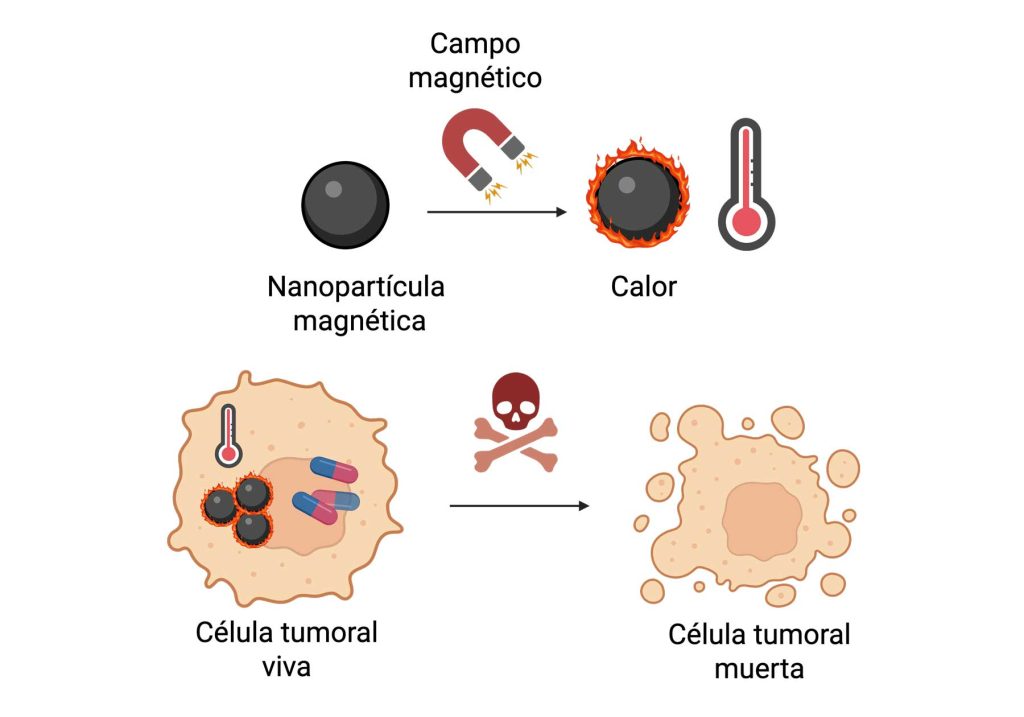
Las nanopartículas magnéticas, compuestas en muchos casos por óxidos de hierro, se comportan como pequeños imanes y responden a campos magnéticos externos. Eso hace que puedan ser guiadas con un imán desde el exterior del cuerpo, favoreciendo su acumulación en el tejido a tratar. Además, si estas nanopartículas se encuentran en un campo magnético alternante, giran para alinearse con el sentido del campo y estos giros repetidos generan calor. Debido a este calor, las células de los tumores pueden volverse muy sensibles y la quimioterapia las puede eliminar con más facilidad (Figura 3).
Cuando se administran nanopartículas de manera intravenosa, éstas tienen que viajar a través del torrente sanguíneo. La sangre es un fluido complejo que contiene entre otros componentes proteínas que se adhieren a la superficie de las nanopartículas, formando una capa conocida como corona de proteínas. ¿Cuál es el problema? Que esa nanopartícula tan bien diseñada se transforma en otra cosa, y puede que ya no sirva para la aplicación que se tenía en mente. Esto puede ocurrir por varias razones:
- El sistema inmune cree que las nanopartículas son intrusos y lleva a cabo procesos para su eliminación, por lo que acaban en el bazo o en el hígado.
- Las nanopartículas quedan tan recubiertas por las proteínas de la sangre que, aunque lleguen a las células «diana», no pueden unirse a los receptores (como si la cerradura estuviera taponada y la llave no entrase).
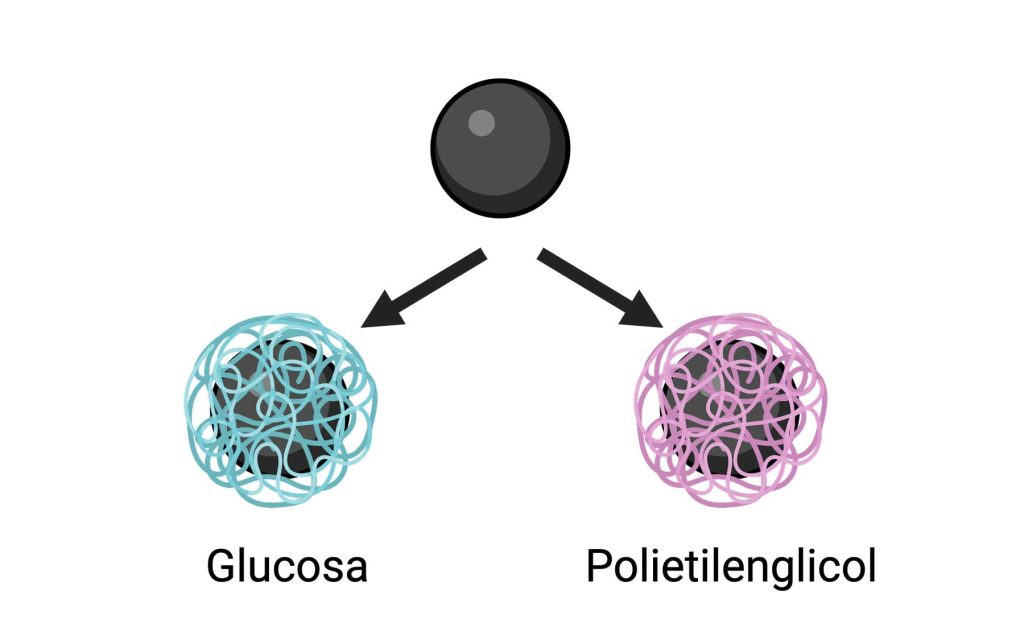
Saber qué ocurre con las nanopartículas dentro del cuerpo es un trabajo de detectives realmente complejo, y eso es lo que hemos investigado. Hemos usado las mismas nanopartículas iniciales, pero las hemos “disfrazado” de dos maneras: recubriéndolas con glucosa (un azúcar) o con polietilenglicol (un tipo especial de plástico), para ver qué ocurre con ellas en el cuerpo (Figura 4).
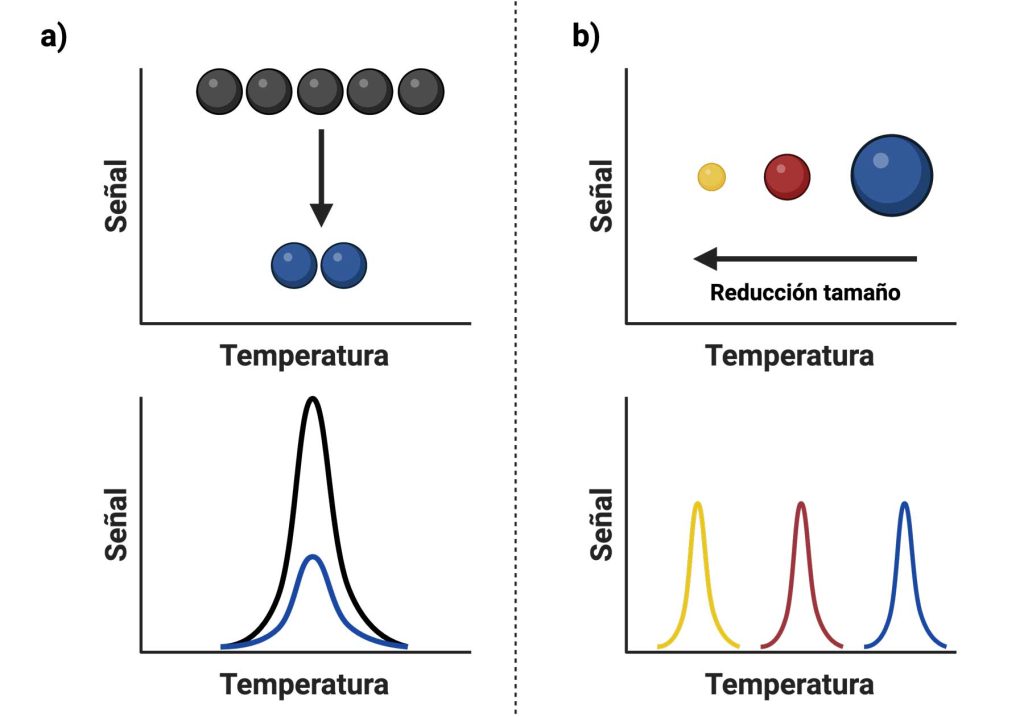
Para saber que pasa una vez hemos “disfrazado” a las nanopartículas, después de inyectarlas en la vena de la cola de los ratones, hemos extraído los principales órganos y utilizado pequeñas porciones de cada órgano. Aprovechando que las nanopartículas son pequeños imanes, hemos podido medir su “huella dactilar magnética” en función de la temperatura. Para ello, hemos usado un instrumento que es como una especie de “detector de metales”. Esto nos ha permitido no sólo detectar las nanopartículas, sino también conocer si han cambiado su concentración o tamaño (Figura 5). En la Figura 5a, podemos observar que a mayor concentración de nanopartículas, mayor es la señal que detectamos. Por otro lado, en las nanopartículas de mayor tamaño observamos su señal a temperaturas más elevadas (Figura 5b).
¿Qué hemos obtenido?
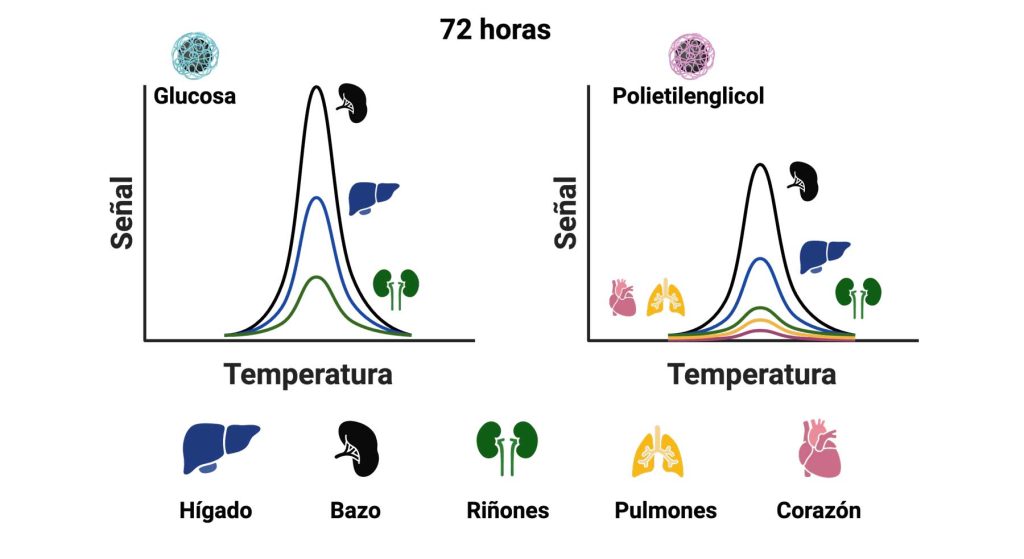
Analizando los diferentes órganos, descubrimos que 72 horas (3 días) después de administrarlas a los ratones, las nanopartículas con glucosa se encontraban principalmente en hígado y bazo, mientras que las nanopartículas con polietilenglicol también habían llegado a los riñones, pulmones y corazones de los animales (Figura 6).
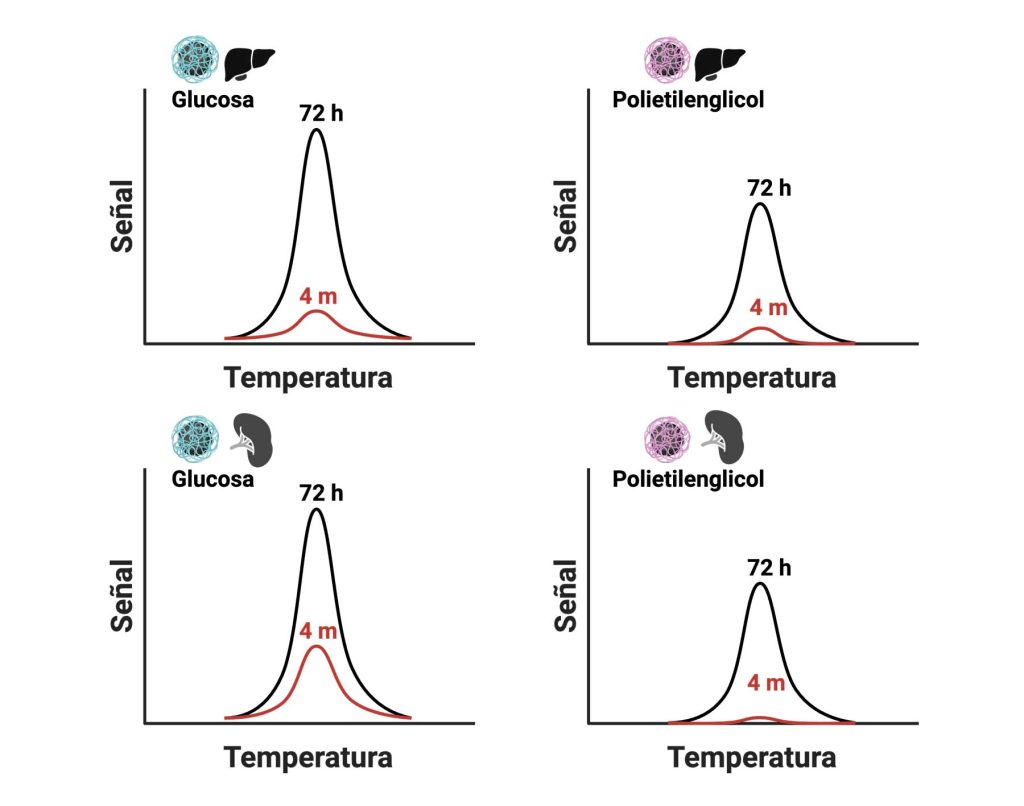
Pero, ¿qué pasa a tiempos más largos? Después de 4 meses, las nanopartículas con glucosa seguían presentes en el hígado y el bazo de los ratones, pero las de polietilenglicol solamente estaban en el hígado (Figura 7). No pudimos detectar la señal de las nanopartículas en ningún otro órgano.
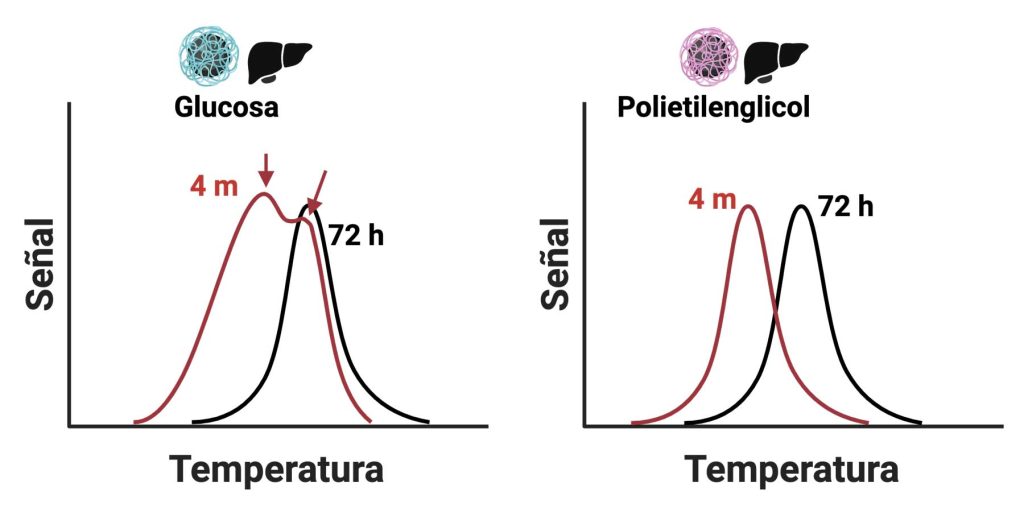
Al observar las diferencias de biodistribución entre los dos tipos de nanopartículas después de 4 meses, la siguiente pregunta que nos hicimos, como buenos detectives, fue si las nanopartículas estaban exactamente igual que cuando las inyectamos o si se habían transformado a lo largo del tiempo.
Analizando más en profundidad la señal de ambas nanopartículas en el hígado (Figura 8), vimos que, en el caso de las nanopartículas recubiertas con polietilenglicol, la señal se había desplazado hacia temperaturas más bajas, lo cual indicaba una disminución de su tamaño. En las nanopartículas con glucosa sin embargo pudimos detectar dos poblaciones de nanopartículas (indicadas con flechas en la Figura 8): una sin modificar, y otra en la que las nanopartículas tenían un tamaño menor.
La disminución del tamaño es una indicación de una posible degradación de las nanopartículas, fenómeno relacionado directamente con su recubrimiento. Las coronas de proteínas de cada tipo de nanopartículas son diferentes, y eso hace que su comportamiento dentro de los ratones sea distinto.
Conclusiones
El campo de investigación de las nanopartículas para aplicaciones médicas está en crecimiento. Sin embargo, queda mucho por explorar. Nuestra investigación ha permitido demostrar que el recubrimiento superficial y la corona de proteínas que se forma cuando las nanopartículas entran en contacto con la sangre de ratones hacen que su degradación sea diferente. Pero todavía son necesarios más estudios que nos ayuden a entender mejor cómo se comportan las nanopartículas en el organismo y cómo desarrollar formas de controlar su comportamiento a largo plazo. Para ello, es necesaria la colaboración entre investigadores e investigadoras de diferentes campos, como la biología, la química, la medicina y la física.
Glosario
Proceso de seguimiento y análisis del movimiento y distribución de compuestos específicos (medicamentos, nanopartículas, etc.) dentro de un animal de experimentación o un sujeto humano.
Capa de recubrimiento de proteínas absorbidas en la superficie de las nanopartículas al entrar en contacto con fluidos biológicos que contienen proteínas (plasma, sangre, etc.).
Transformación sufrida por una sustancia (en este caso, las nanopartículas). La degradación puede ser química, biológica, etc.
Materiales con una o más dimensiones externas o una estructura interna a escala nanométrica.
Partículas con una o más dimensiones del orden de 100 nm o menos.
Tratamiento con medicamentos para interrumpir la formación de células cancerosas mediante su destrucción o impidiendo su multiplicación.
RECURSOS DEL ARTÍCULO
Artículo original:
Grazyna Stepien, María Moros, Marta Pérez-Hernández, Marta Monge, Lucía Gutiérrez, Raluca M. Fratila, Marcelo de Las Heras, Sebastián Menao Guillén, Juan José Puente Lanzarote, Contxita Solans, Julián Pardo, Jesús M. de la Fuente. Effect of Surface Chemistry and Associated Protein Corona on the Long-Term Biodegradation of Iron Oxide Nanoparticles In Vivo. ACS Applied Materials and Interfaces 2018, 10, 4548−4560.
Artículo adaptado por:
Raluca Fratila
Grupo de investigación E15_23R BIONANOSURF (Gobierno de Aragón)
Instituto de Nanociencia y Materiales de Aragón (Unizar-CSIC)
Mª José Sáez Bondía
Grupo Beagle de investigación en didáctica de las Ciencias Naturales (Gobierno de Aragón)
Instituto Universitario de Investigación en Ciencias Ambientales de Aragón (Unizar)